
发布日期:2022-05-11浏览次数:1229来源:蓝景科信
美国北卡罗莱纳大学莱恩伯格综合癌症中心的Yisong Wan课题组在Nature期刊上发表了题为“Reversing SKI–SMAD4-mediated suppression is essential for TH17 cell differentiation”的研究成果。该研究借助高通量测序,揭示了一种触发TH17细胞产生的新机制。美国Bioo Scientific的NEXTflex Rapid DNA-seq kit 助力完成ChIP-seq测序文库构建过程。


研究背景
辅助性T细胞17(Th17)作为CD4+T细胞的一种亚型,在宿主防御、炎症反应、以及自身免疫等环节具有重要作用。TGFβ与IL-6在Th17细胞的分化过程中,发挥着关键作用。TGFβ和IL-6共同作用可以诱导初始CD4+T细胞分化成Th17,但具体的调控细节仍不清楚。在一项研究中,来自美国北卡罗莱纳大学莱恩伯格综合癌症中心的Yisong Wan课题组揭示了一种触发Th17细胞产生的新机制。他们希望这些研究成果能够帮助人们寻找到治疗自身免疫性疾病和癌症的新方法。
研究材料
Smad4fl/fl, Tgfbr2fl/fl, Cd4cre, ERCre, Rag1−/−, Rorc−/−, Cre-dependent-Cas9 knockin (CdC)29和CD45.1小鼠,来自北卡罗莱纳大学。
实验方法和研究结果
通过对样本进行流式细胞分选、免疫印迹等方法分析,结合ChIP-seq [NEXTflex Rapid DNA-seq kit (Bioo Scientific )]和RNA-seq两种高通量测序以及数据分析,研究Th17细胞分化与产生机制。
1. 缺乏Smad4时Th17的细胞分化情况
使用TGFβR 抑制剂(i),IL-6+TGFβR抑制剂(IL-6+i)或IL-6+TGF-β(IL6+TGF-β)激活Smad4fl/fl(S4 KO)小鼠。运用流式细胞术检测IL-17A+细胞(图1a),并同样使用流式细胞术分别检测WT;Cd4cre小鼠,Smad4fl/fl(S4 KO);Cd4cre小鼠,Tgfbr2fl/fl(RII KO);Cd4cre小鼠,Smad4fl/fl;Tgfbr2fl/fl(S4-RII DKO)小鼠外周淋巴结(pLN)、脾脏中IL-17A+CD4+和IFN-γ+CD4+细胞的百分率(图1b)。结果显示,当缺乏Smad4时,Th17细胞进行分化。
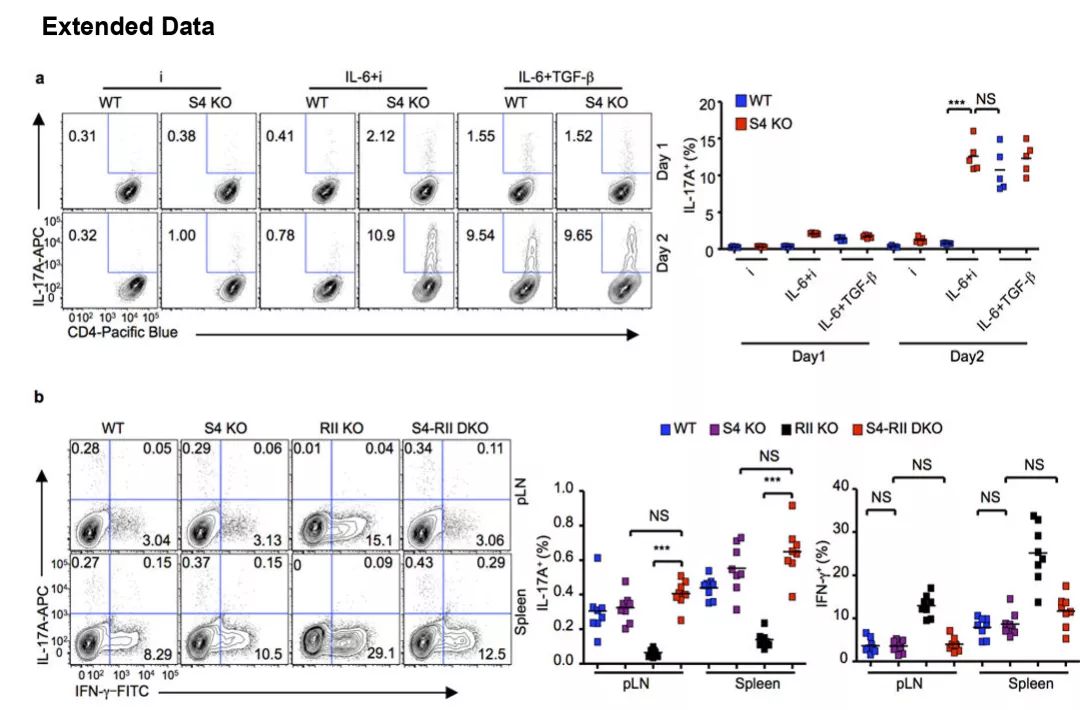
图 1. 缺乏Smad4时Th17细胞的分化情况
2. Smad4 与 RORγt 表达关系分析
IL-6和TGFβR抑制剂激活Smad4fl/fl(S4 KO)小鼠,通过qRT-PCR方法分析Th17相关基因mRNA的表达,并对收集的总RNA进行RNA-seq分析(图2a/2b)。
IL-6和TGFβR抑制剂激活Smad4fl/fl(S4 KO)小鼠、Smad4fl/fl;Tgfbr2fl/fl(S4-RII DKO)小鼠,通过qRT-PCR方法分析Th17相关基因mRNA的表达(图2c/2d)。
IL-6和TGFβR抑制剂激活Smad4fl/fl(S4 KO)小鼠、Tgfbr2fl/fl;Smad4fl/fl (S4-RII DKO)小鼠,通过免疫印迹法检测RORγt蛋白表达;并对Smad4fl/fl (S4 KO)激活后的细胞使用Ctrl IgG抗体和Smard4抗体进行ChIP分析,用Smad4抗体进行ChIP-seq分析(图2e/2f/2g/2h)。结果显示,Smad4 可抑制 RORγt 的表达。
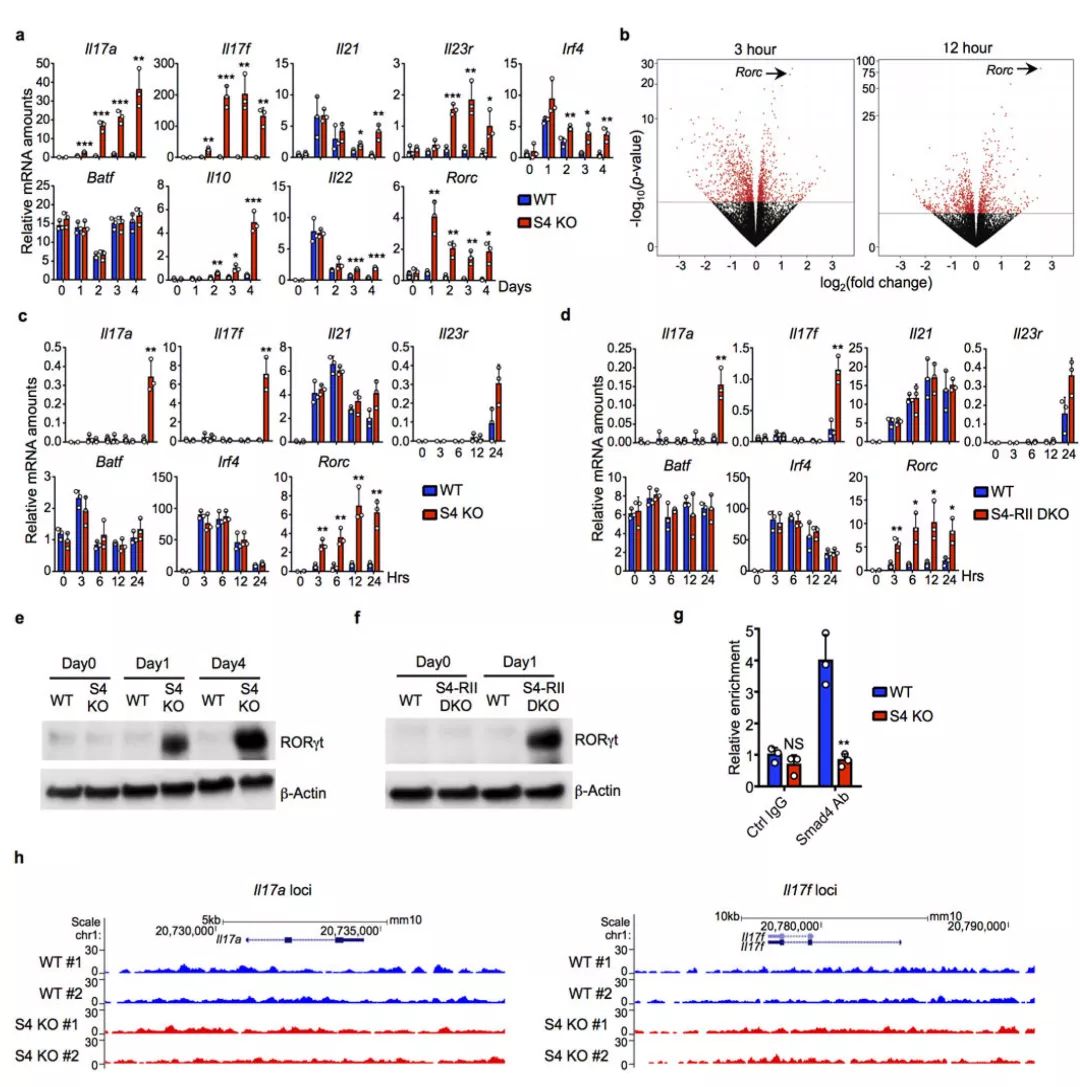
图 2. Smad4 抑制 RORγt 表达
3. Ski鉴定和低剂量TGF-β对Ski的降解作用分析
定量IP-MS(免疫沉淀和质谱)蛋白质组策略在不同条件下鉴定Smad4结合蛋白的示意图。在一个方案中,在TGF-β信号缺失的情况下鉴定Smad4结合蛋白;在另一个方案中,鉴定在 TGF-β 刺激的干扰下与Smad4相互作用的蛋白质(图3a)。
使用 IL-6存在激活WT小鼠,并显示TGF-β的剂量。通过免疫印迹检测Ski蛋白的表达(图3b),以流式细胞术检测IL-17A+和Foxp3+细胞(图3c)。
使用 IL-6存在激活Cd4cre;Smad2fl/fl (S2 KO)小鼠,另外1小时加或不加10μM SIS3(Smad3磷酸化的特异性抑制剂)。免疫印迹法检测Ski蛋白表达及Smad3磷酸化(图3d)。
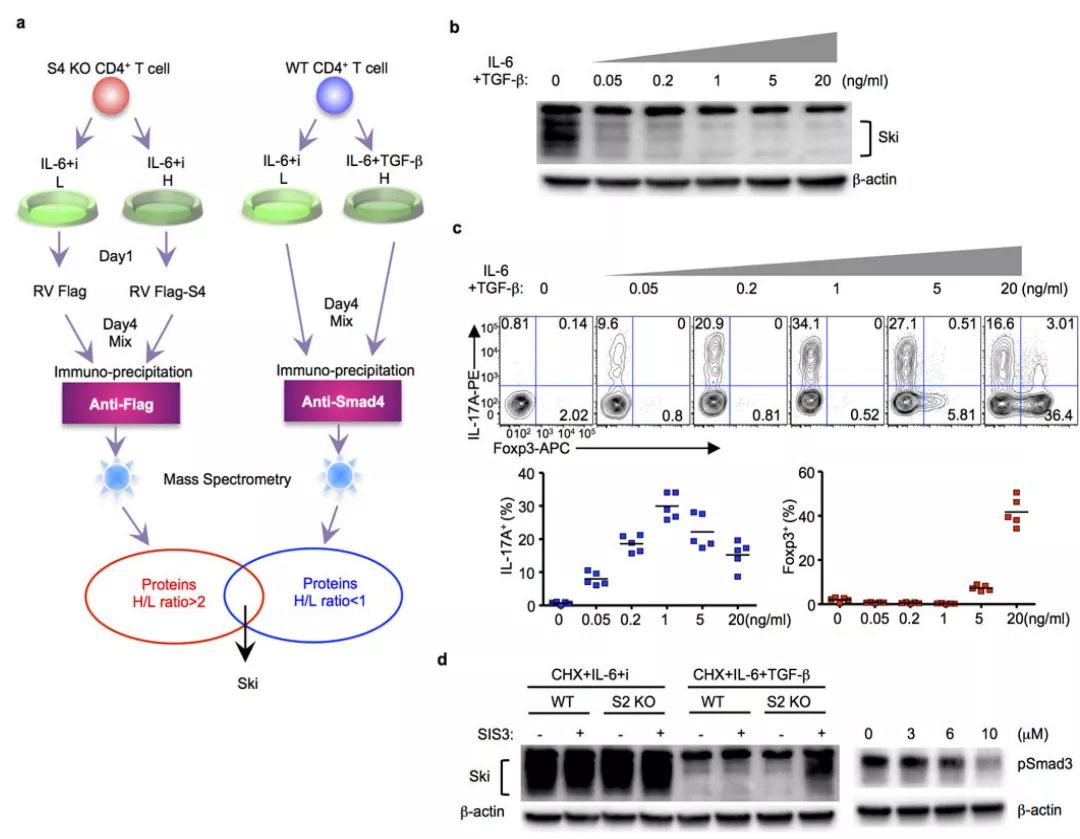
图3. Ski鉴定和低剂量TGF-β对Ski的降解作用。
4. Ski和Smard4与Th17的分化关系分析
使用IL-6和TGFβR抑制剂激活CD4+T细胞(骨髓嵌合小鼠淋巴结和脾脏中分离)。细胞由gRNA转导入野生型(WT)供体。细胞由gRNA转导入CD4Cre;CdC(Ski KO)供体,通过流式细胞术检测IL-17A+细胞(图4a)。
使用IL-6和TGF-β激活来自WT小鼠的CD4+T细胞,然后进行转染或与逆转录病毒共转染。采用流式细胞术检测IL-17A表达的转染(GFP+)或共转染(GFP+Thy1.1+)T细胞(图4b)。
使用IL-6+TGFβR抑制剂(i)或IL-6+TGF-β激活WT和 Cd4cre;Smad4fl/fl(S4 KO)小鼠。采用对照IgG抗体或Ski抗体进行ChIP检测(图4c)。结果显示,Ski和Smard4协同抑制Th17的分化。
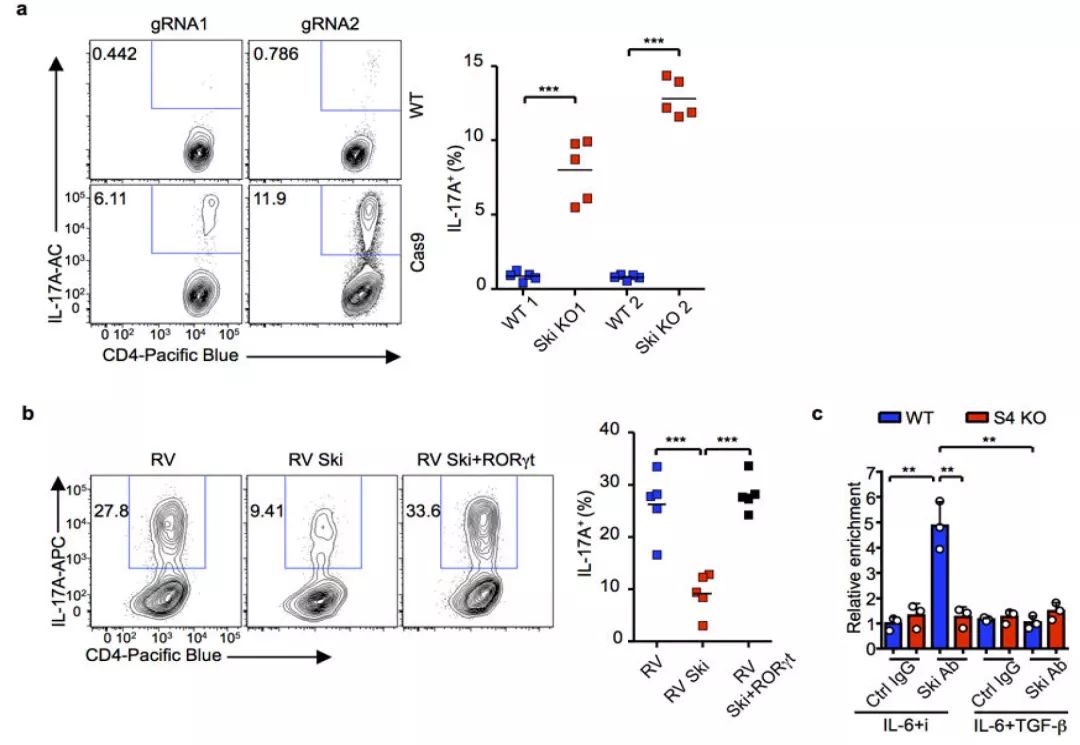
图4. Ski和Smard4协同抑制Th17的分化
5. Th17细胞分化机制
RORγt的表达通过IL-6-STAT3信号转导而增强,但受到与去乙酰化的Rorc位点相关联并含HDAC活性的Sky-Smad4复合物的抑制(图5a)。
TGF-β或Activin信号触发Ski退化。Ski-Smad4复合物的破坏使HDAC活性与Rorc位点分离,并允许RORγt表达和Th17细胞分化(图5b)。结果,TGFβ逆转Ski-Smad4 对Th17细胞分化的抑制作用。
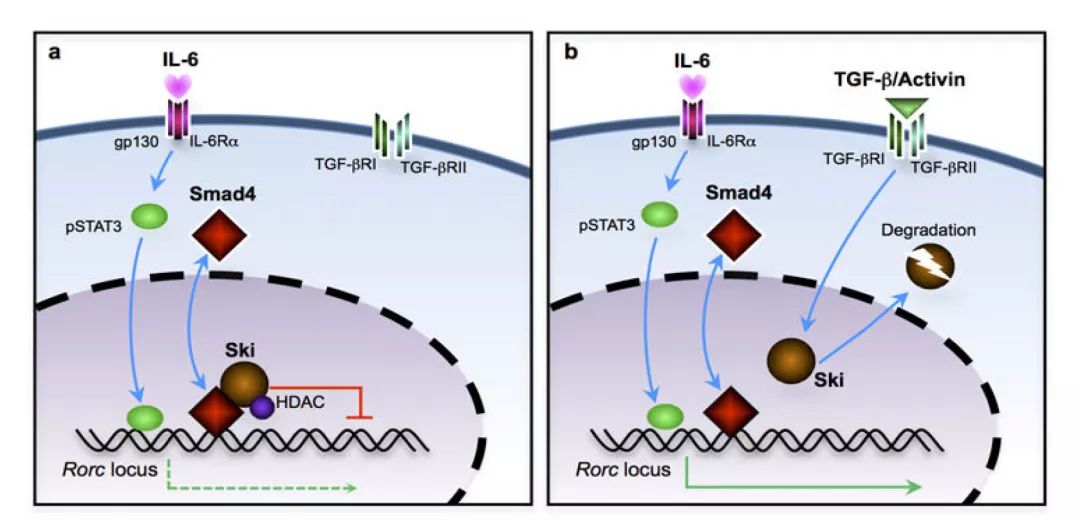
图 5. TGF-β超家族信号转导逆转Ski-Smad4复合体介导的对RORγt表达的抑制,活化T细胞以诱导Th17细胞分化。
论文结论
IL-6可以促进Th17细胞的产生,Ski-Smad4则抑制Th17细胞的分化。体内由SKI-SMAD4复合体介导的信号通路能抑制关键的RORγt受体表达,而TGFβ能够“逆转”这种抑制。与这个结果相一致,在缺乏Smad4的CD4+T细胞中,即便没有TGFβ的作用,它也能分化成Th17细胞。这项结果揭示了TGFβ控制Th17细胞分化中的关键机制,也表明Ski-Smad4有望成为潜在的药物靶标,用于治疗和Th17相关的疾病(已知T细胞中的Smad4缺乏与胃癌和Th17产生相关联)。
Bioo Scientific的NEXTflex Rapid DNA-seq kit产品特点:
1) 灵活的DNA起始量:1 ng-1 ug
2) 2小时或者更短的时间完成整个实验流程,减少人工操作时间
3) 较高的接头连接效率,产出大量不同的Reads
4) 减少建库偏差
5) 灵活的接头方案——多达384种接头用于多重测序
6) 经Illumina 测序平台验证
7) 可用于单端、双端和多重基因组DNA文库构建